Ensayos en monosacáridos
Ensayo de Molisch:
Tanto las pentosas como las hexosas son deshidratadas por el ácido sulfúrico concentrado, para formar derivados de furano (furfural o hidroximetilfurfural). Al agregar alfa-naftol se forman compuestos de condensación coloreados en la interfase de ambas soluciones.

Se observa el anillo coloreado central que verifica la presencia de una hexosa.
Ensayo de Fehling:
Todos los glucidos que tienen hidroxilo hemiacetalico o hemicetalico libre reducen al ion Cu++ en medio alcalino, a Cu+. Los reactivos que suelen usarse, contienen sustancias que aumentan la solubilidad del ion Cu++ en medio alcalino de tartrato de sodio y potasio.

precipitado rojizo de óxido cuproso formado entre el reactivo de Fehling y la glucosa
Ensayo de Tollens:
Se trata de la reacciónde oxidación con Ag+ en medio amoniacal de un monosacárido . La reacción es enteramente análoga a la anterior, dando en este caso el espejo de plata (Ago) en las paredes del tubo.
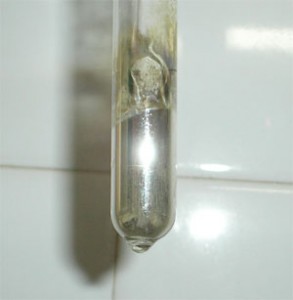
Espejo de plata producto de la reacción positiva de Tollens de la glucosa
Reacción con fenilhidracina:
Los glucidos que contienen función cetona o aldehido reaccionan en presencia de un exceso de fenilhidrazina generando osazonas coloreadas.

Aparición del color de la osazona de la glucosa
Ensayos en disacáridos
Poder reductor:
El ensayo de Fehling permite diferenciar entre disacáridos reductores y no-reductores. De esta forma para el caso de la maltosa se observará el óxido cuproso producido por la reducción del metal, mientras que la sacarosa no reaccionará por no poseer el OH hemiacetálico libre.

Comparación de la reacción de Fehling frente a un disacárido reductor (maltosa) y uno no-reductor (sacarosa)
Hidrólisis de la sacarosa:
La sacarosa puede hidrolizarse rápidamente en solución acuosa, mediante catálisis con un ácido mineral en caliente. Luego de realizada la reacción, se verifica que el disacárido se hidrolizó mediante el ensayo de Fehling, que en este caso será positivo:

Luego de hidrolizada la sacarosa, la solución resultante de glucosa y fructosa reacciona frente al reactivo de Fehling.
Ensayos en polisacáridos
Reacción con Iodo:
El iodo es capaz de formar con los átomos de las partes helicoidales de la molécula de almidón un complejo de color azul:

Complejo de color azul entre el iodo y el almidón
Al calentar la solución que posee el complejo, ésta se decolora debido a la deformación de la molécula debida al calor entregado; al enfriarse, la estructura helicoidal se recupera y reaparece el color del complejo.
Ensayo de Fehling:
La reacción de un polisacárido como el almidón frente al reactivo de Fehling será negativa debido a la poca presencia de OH hemiacetálicos en una molécula que puede llegar a contener más de cien mil unidades de glucosa.

El almidón no reacciona frente al reactivo de Fehling
Hidrólisis del almidón:
Las uniones glicosídicas del amidón pueden hidrolizarse rápidamente en solución acuosa, mediante catálisis con un ácido mineral en caliente o por medio de enzimas presentes en la saliva.El avance de la hidrólisis puede seguirse mediante la reacción con iodo, hasta no observarse la aparición del color azul debido a la presencia de fragmentos pequeños de oligosacáridos.

Puede observarse la diferencia en el color del iodo frente a distintas cadenas de glucido: azul para el almidón (izq), rojo para las dextrinas (centro) y amarillo para la matosa (der)
Finalmente puede verificarse la hidrólisis mediante el ensayo de Fehling, que en este caso será positivo:

Resultado del test de Fehling para el almidón y el producto de su hidrólisis.
Autores: María Emilia Pérez, Andrea Amaro, Celina Guiles, Gustavo Pasquale, Federico Ducasse y Diego Ruiz


















